丁俊军团队开发首个iPS细胞乳腺癌疾病模型
乳腺癌是女性中发病率最高的恶性肿瘤,并且是全球女性癌症相关死亡的主要原因。探究其发生机制是乳腺癌研究领域中的重要问题1,2。现有患者来源的癌症模型,如患者衍生细胞系、患者衍生类器官和异种移植模型3–6,在重现乳腺癌早期发生过程方面存在局限。基于大规模的组学数据,研究者已发现许多与乳腺癌的发生有关的基因突变,但在人类体系中经过“突变-表型”相关验证的基因较少。在人类肿瘤发生体系中,对这些突变的致癌机制的探索更是不足7。部分原因在于目前缺乏源自人类、能模拟乳腺癌早期发生过程的模型4。因此,迫切需要一种源自人类的模型来模拟从突变到肿瘤发生的全过程。
2025年7月25日,中山大学干细胞与组织工程教育部重点实验室丁俊军团队在Science Advance发表了题为Human iPSC-based breast cancer model identifies S100P-dependent cancer stemness induced by BRCAl mutation的研究成果。该研究中,开发了一个新的乳腺分化方法,用于从人类诱导多能干细胞(iPSCs)中生成功能性乳腺样细胞(Mammary-like Cells, MCs )。基于这种分化方法,利用携带生殖系BRCA1突变的患者衍生的iPS细胞构建了乳腺癌模型。这是首个人源的iPS细胞乳腺癌模型,可用于研究肿瘤发生发展机制并寻找潜在的治疗靶点。

模型的构建及主要发现如下:
1、功能性乳腺细胞诱导分化方法的建立
iPS细胞模型的优势是能通过重编程及诱导分化重现病人乳腺的发育及肿瘤发生过程。而为了构建iPS细胞乳腺癌模型,第一个难关是目前没有高效的乳腺分化方法。研究人员基于正常乳腺发育起源于表皮外胚层,设计了一个‘两步走’的乳腺分化方法。首先将iPS细胞分化为表皮外胚层细胞,再向下游分化获得乳腺细胞(iPSC-MCs)。为了验证获得的细胞是否与正常乳腺细胞类似,研究人员检测了其表达谱,发现分化获得的乳腺细胞在表达层面与正常乳腺细胞类似;并且经过体内外功能验证,证明分化获得的细胞能分泌乳蛋白及重建小鼠乳腺功能。至此,首个可重现患者遗传背景且功能完备的人类乳腺分化体系正式建立,为后续乳腺癌模型构筑奠定了坚实平台。
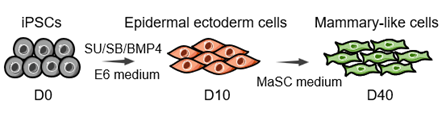
图1.功能性乳腺细胞诱导分化方法示意图
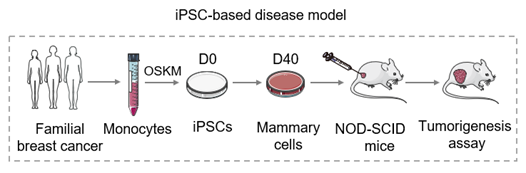
2、病人家系iPS细胞乳腺癌模型的构建
为了研究乳腺癌发生的分子机制,研究人员选取了携带BRCA1突变(BRCA1mut)的遗传性乳腺癌病人家系建立模型,并构建了BRCA1突变修复(BRCA1cor)的iPS细胞作为对照。iPS细胞乳腺癌模型的构建过程概括来说,首先将取自病人家系的单核细胞重编程为iPS细胞,通过新开发的功能性乳腺细胞诱导分化方法,将iPS细胞诱导分化为乳腺样细胞,并将细胞注射到小鼠体内进行成瘤检测。突变组成功诱导了肿瘤形成,而修复组与野生型组则没有肿瘤形成。并且,研究人员发现该模型获得的肿瘤在分子分型和基因表达谱上与病人原发肿瘤,及TCGA数据库中三阴性乳腺癌高度匹配。另一方面,由于BRCA1蛋白缺陷导致的基因组不稳定是BRCA1突变相关癌症的重要表现。通过全外显子测序,研究人员发现BRCA1突变的iPS模型中出现了临床相关的遗传改变,并在一定程度上模拟了突变的积累。综上所述,基于iPS细胞的乳腺癌模型在分子表达和遗传变异方面都与临床肿瘤相似,可以作为研究乳腺癌发生和进展的“人源化”新系统。
3、新靶点S100P作为BRCA1的下游因子增强了肿瘤干性
为了研究BRCA1突变导致肿瘤发生的机制,研究人员通过分析iPS乳腺癌模型构建过程中的BRCA1突变组与对照组的基因表达差异,找到了BRCA1的下游靶点S100P。并通过功能验证发现其发挥促进肿瘤发生的功能。机制上,BRCA1突变通过上调S100P蛋白增强了正常乳腺上皮细胞肿瘤干性,这很可能是其促进恶性转化和肿瘤进展的关键因素。
综上所述,该研究开发了一个高效的iPSCs分化为乳腺细胞谱系的方法,并构建了首个iPSC细胞乳腺癌模型,成功再现了BRCA1突变驱动的肿瘤发生和突变累积。通过对该模型发生发展过程中数据的分析,研究进一步发现了S100P作为BRCA1突变相关乳腺癌的潜在下游靶点,提出了S100P抑制剂有望成为预防和治疗此类乳腺癌的潜在药物。这一突破填补了人类遗传性乳腺癌早期研究的模型空白,为BRCA1突变高风险人群的精准预防和TNBC的靶向治疗提供了全新策略,标志着“以患者细胞模拟患者疾病”的乳腺癌个体化医学迈出关键一步。
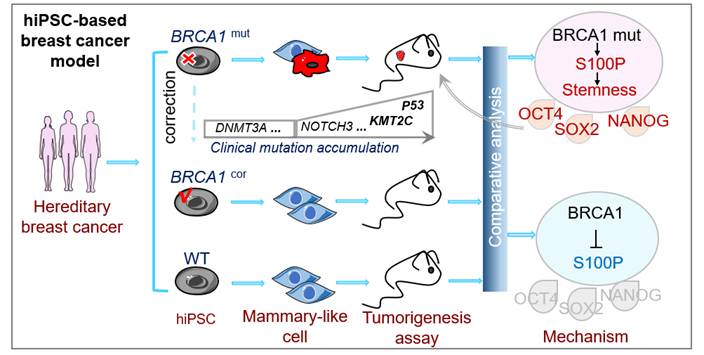
图3. iPS细胞乳腺癌模型发现S100P作为BRCA1突变的下游促进肿瘤干性
我教育部重点实验室丁俊军教授、徐州医科大学白津教授、中山大学附属七院黄东锋和广州国家实验室索生宝研究员为该论文的共同通讯作者。广州国家实验室刘静馨博士(原我教育部重点实验室博士后),我教育部重点实验室博士生赵偲(已毕业)、陈嘉豪博士研究生、曾彭归航博士研究生为本文的共同第一作者。浙江省肿瘤医院胡海团队,广州医科大学霍永良团队提供了大力帮助。
原文链接://www.science.org/doi/10.1126/sciadv.adi2370
参考文献:
1.Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. doi:10.3322/caac.21492
2.Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209-249. doi:10.3322/caac.21660
3.Greaves M. Evolutionary determinants of cancer. Cancer Discov. 2015;5(8):806-820. doi:10.1158/2159-8290.CD-15-0439
4.Ben-David U, Beroukhim R, Golub TR. Genomic evolution of cancer models: Perils and opportunities. Nat Rev Cancer. 2019;19(2):97-109. doi:10.1038/s41568-018-0095-3
5.Wang Y, Ye F, Liang Y, Yang Q. Breast cancer brain metastasis: Insight into molecular mechanisms and therapeutic strategies. Br J Cancer. 2021;125(8):1056-1067. doi:10.1038/s41416-021-01424-8
6.Hofbauer LC, Bozec A, Rauner M, Jakob F, Perner S, Pantel K. Novel approaches to target the microenvironment of bone metastasis. Nat Rev Clin Oncol. 2021;18(8):488-505. doi:10.1038/s41571-021-00499-9
7.Ginsburg O, Ashton-Prolla P, Cantor A, Mariosa D, Brennan P. The role of genomics in global cancer prevention. Nat Rev Clin Oncol. 2021;18(2):116-128. doi:10.1038/s41571-020-0428-5

